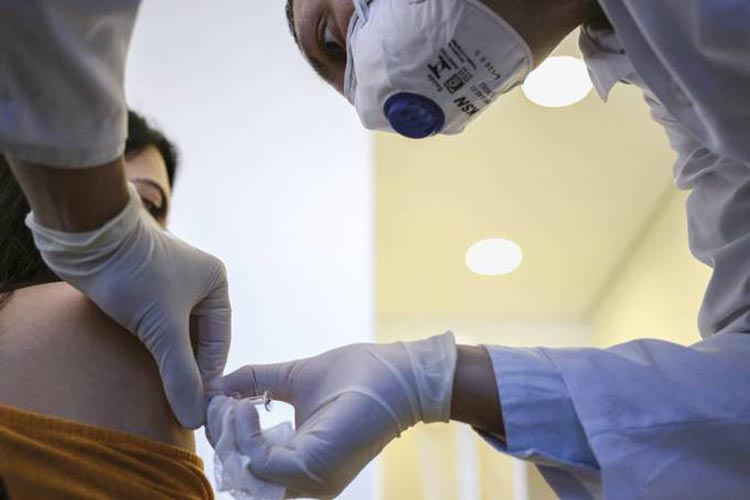
 O Brasil está fincado no epicentro mundial dos estudos com os testes das principais vacinas desenvolvidas contra o novo coronavírus. A importante posição dará ao país privilégios no recebimento e distribuição dos imunizantes. Mas isso não é tudo para os produtos chegarem ao mercado.
O Brasil está fincado no epicentro mundial dos estudos com os testes das principais vacinas desenvolvidas contra o novo coronavírus. A importante posição dará ao país privilégios no recebimento e distribuição dos imunizantes. Mas isso não é tudo para os produtos chegarem ao mercado.
Ao fim das pesquisas, caberá a Agência Nacional de Vigilância Sanitária (Anvisa) dar o registro, ou seja, a liberação, aos fármacos. E eis mais uma boa notícia. Em um esforço sem precedentes na história, a entidade deverá avaliar os documentos fornecidos pelos laboratórios em até 30 dias. O prazo máximo será de 60 dias. Para se ter uma ideia, antes da pandemia, um aval desse porte levaria até um ano. Paralelamente a essa decisão, a organização constituiu um comitê especial para avaliar as autorizações para estudos científicos e liberação de vacinas e medicamentos ligados à Covid-19. O time tem aproximadamente uma dezena de participantes (entre estatísticos, biomédicos e farmacêuticos) e se reúne entre três e cinco vezes na semana para dar um parecer sobre as documentações que chegam à organização. “Percebemos logo no começo da pandemia que precisávamos nos reorganizar. Do contrário, não conseguiríamos responder com a velocidade necessária para o momento”, diz o gerente geral de medicamentos da agência, Gustavo Mendes. “Essa formação de comitê foi muito positiva, pode ser que adotemos essa postura em alguns casos após a pandemia”, analisa. A anuência (como é chamada a autorização) de um estudo para vacina também foi acelerada. Até então, o trâmite poderia legalmente levar até 90 dias, mas com a pandemia este prazo para liberação foi reduzido para 72 horas. “O olhar coletivo desse comitê sobre os pedidos faz com que sejamos mais rápidos”, conta Mendes.